万字长文:单细胞测序在脑科学研究中的应用
2021年6月28日

编语
当前,生命科学正在步入单细胞时代,单细胞技术的应用正在剧烈的改变我们对生物学的认知。 本期,我们为大家带来一篇发表于《Neuron》的单细胞综述,尽管该文主要聚焦脑科学研究, 但对单细胞技术做了非常详尽的阐述和讨论,所以对其他学科领域也十分具有参考意义。
摘要
单细胞测序技术,包括转录组和表观基因组,正在转变我们对神经回路中细胞构造的理解。通过对数以百万计细胞中的分子信号进行测定, 单细胞测序技术能够系统地对脑细胞类型进行全面描述。这揭示了塑造细胞身份的基因调控机制,为理解脑细胞群体间的发育与进化关系提供了视角。 单细胞测序数据能辅助设计靶向脑回路组分功能的研究工具,将分子信号与解剖、联结、形态和生理学相联系。 这里,我们就单细胞转录组测序和表观基因组测序技术,单细胞数据整合分析,以及在神经科学中的应用进行详细讨论。
前言
脑细胞是复杂的生物学机器,其功能由保守的基因表达程序所决定。理解神经细胞类型的分子程序需要对成千上万的基因进行表达定量,以此来找到细胞之间的差异。 同时,需尽可能地捕获更多的细胞,以便于发现罕见的细胞类型以及对细胞群体的异质性做出准确评估。然而,既要分析大量的基因,又要研究大量的细胞, 从传统来看这两件事情相互矛盾。一般情况下,少量样本对应分析大量基因,或者大量样本对应分析少量基因。现在,海量单细胞测序技术的出现,使得我们从更大范围、更高分辨率来研究脑细胞构成成为可能。 DNA或RNA测序使得分子特征能被测量,从而揭示细胞身份。RNA分子的表达丰度构成转录组,而DNA和组蛋白上的化学修饰以及染色质构象共同构成表观基因组(图1A)。 数以万计的基因与成千上万的顺势调控元件相互作用,从而决定细胞身份。神经科学最基本的目标就是去理解脑回路网络信息加工的过程,去理解所出现的适应性表现或行为。 因此,神经科学家自然而然认识到单细胞测序技术为脑科学研究带来的新机会。 目前,脑组织中RNA和DNA分析主要是进行bulk测序,最终获得的是组织中所有细胞的平均结果,致使一些罕见的细胞类型信号丢失。 虽然通过对细胞或细胞核进行纯化分离,能部分的克服存在的问题,但是这些方法高度依赖已知的细胞标志物分子,而实际上很多细胞特异的标志物并不清楚。 单细胞测序技术不依赖于纯化特定的细胞群体,它们主要有三大特征:细胞数目、基因数目、空间位置信息(图1B)。 单细胞转录组测序能够获得每个细胞的RNA表达情况,包括mRNA变体;而单细胞表观基因组测序则能检测DNA甲基化,染色质可及性,染色质构象,这些特征在整个生命活动中控制着基因表达。 然而,转录组测序只能获得静态的转录组,即只能反映细胞在组织采集那个时刻的状态;而表观遗传标记包含短期和长期的状态。 总而言之,单细胞转录组和表观基因组技术为研究特定脑细胞类型在生理和病理下的功能角色提供了强有力的工具。
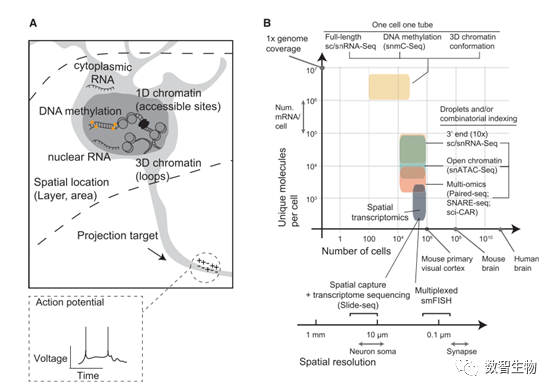
图1、 单细胞测序技术。 A、单细胞测序技术探测转录组和表观基因组信号。B、不同单细胞实验比较。横坐标为细胞数目,纵坐标为基因数目。
一、单细胞转录组测序技术
目前,单细胞RNA测序可以分为平板、液滴、组合索引的方法。平板方法主要是利用荧光激活细胞分选技术(FACS)将细胞分离至每一个小孔里;而液滴方法则是将细胞分离至每一个液滴中;组合索引则是将一群细胞解离至孔,然后标记上孔特异的标签,重新混合,再随机分配到孔,加上标签,重复多次,直到使得每个细胞有较高的概率获得唯一的组合式标签。与平板方法相比,组合索引和液滴方法能够捕获到更多的细胞,并且每个细胞费用更少,但平板方法在基因探测上则更加敏感,且可灵活定制。在量化基因表达的策略上,这些方法存在明显不同(图2A)。液滴方法主要对mRNA的3‘末端或5‘末端进行计数,这就使得它无法对共享5‘或3’末端的变体进行区分鉴定。相反,平板方法能够测定转录本全长,覆盖所有表达的外显子和剪接位点。这些方法已揭示不同的脑细胞使用的变体存在明显差异。 由于脑组织中树突、轴突和神经胶质突起网络的复杂性,一些转录本会在细胞解离期间大量丢失。此外,scRNA-seq不能用于冰冻组织,因为细胞膜在冰冻期间会发生破裂。一个备选方案就是分离细胞核进行RNA测序,即snRNA-seq。细胞核中的RNA约占细胞总RNA的20%-50%,包含了未成熟的RNA。尽管信息量有所丢失,但研究表明snRNA-seq能够像scRNA-seq一样鲁棒地揭示脑细胞类型特异的基因。 相比于scRNA-seq,snRNA-seq受技术误差影响更小。第一,由于核大小均一,所以snRNA-seq更容易无偏向捕获不同的细胞类型。第二,一些细胞,如皮层第5层锥体束神经元,在scRNA-seq细胞解离过程中更容易发生死亡,而采用snRNA-seq则不会。第三,采用snRNA-seq更可能避免组织切割和细胞分离所引起的非生理性转录激活。 由于scRNA-seq和snRNA-seq技术路线不同,因此我们在数据分析和诠释上需要更加细心。比如,scRNA-seq与snRNA-seq的差异表达分析可以反映转录本的细胞定位,一个例子长非编码RNA MALAT1就主要在细胞核中表达。另外,snRNA-seq分析也应该考虑内含子比对,这部分reads占到了总reads的75%以上。外显子与内含子reads的差异可以反映mRNA表达的动态变化。
二、单细胞转录组在神经科学中的应用
2.1 细胞类型鉴定
单细胞技术已经转变了我们对脑细胞类型多样性的理解。最近,scRNA-seq能够从小鼠脑区域一次解析20000-750000个细胞,使我们能够更加系统、全面的研究脑功能。一项更大的研究解析了来自小鼠中央神经系统和外围神经系统的120万个细胞,最终鉴定了379种不同的细胞类型,而这仅代表成年小鼠脑细胞数目的1%,更大规模,尤其是皮质下的区域仍然需要进一步探索。 在人类大脑中,拥有的神经元数目多于小鼠1000倍,全部解析如此庞大的细胞数目是一项巨大挑战。snRNA-seq已经被应用到人类大脑的多个区域,构建了细胞类型分类谱系(图2B-2D)。与小鼠等其他物种进行比较分析,揭示了进化保守和差异的细胞类型信号。scRNA-seq和snRNA-seq也能揭示胶质细胞的多样性,包括少突胶质细胞谱系和小胶质细胞的功能状态。 在脑科学研究中,单细胞研究的一个主要主题就是谷氨酸能神经元和GABA神经元之间巨大的多样性,这已被单细胞DNA甲基化数据所支持。与GABA神经元相比,大脑皮层兴奋性神经元的转录组可能更加异质,这主要是因为它们发源于端脑背侧区域,而GABA神经元则起源于神经节突起。 scRNA-seq也已应用到非哺乳动物的脑中,对发育、细胞调节、衰老等基本问题做出了回答。在果蝇脑细胞中,衰老剧烈地减少了RNA数量。在斑马鱼脑中,不同的神经干细胞群体受到淀粉样蛋白毒性的不同影响。
2.2 发育和可塑性
scRNA-seq揭示了神经和胶质细胞类型在小鼠和人脑发育过程中出现的过程。scRNA-seq/snRNA-seq特别适合研究脑发育过程,因为干细胞和神经祖细胞只是短时间存在,且由于缺少已知的分子标志物使得其很难被纯化分离。通过在多个时间点采样进行scRNA-seq,能够重构发育轨迹,揭示转录因子与下游效应因子动态调控特定神经元群体的过程。此外,也可以根据细胞中的体细胞突变,来构建分化轨迹。除了发育动态过程研究,由神经活动和可塑性而引起的基因表达变化也能被评估。
2.3 细胞类型与疾病
通过解析病人的脑组织,单细胞技术能获得疾病的转录组信号。研究人员通过对48个阿尔兹海默症患者的脑组织中的超过80000个细胞进行snRNA-seq, 鉴定出比bulk RNA-seq数据更多的差异表达基因。有趣的是,胶质细胞一些差异表达基因仅能在snRNA-seq中探测到,而在bulk测序结果中却不能发现,这主要是因为胶质细胞在整个组织中RNA贡献较低所致。除了应用在阿尔兹海默症中,其他疾病像抑郁、自闭症也已经得到应用。鉴定与疾病相关的细胞类型非常重要,但挑战很大,因为单细胞聚类的偏向性会显著地影响结果。
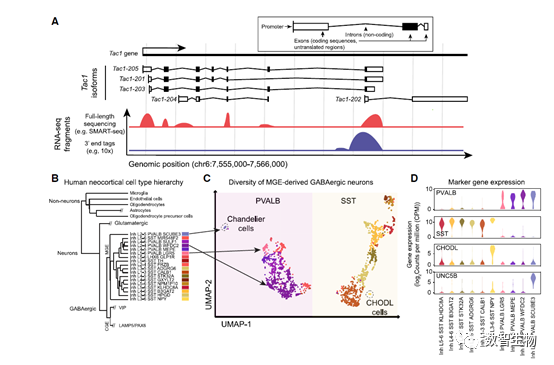
图2、 单细胞转录组测序技术。 A、小鼠基因Tac1,编码神经肽段前体是皮质中GABA能神经元细胞的特异性标志基因。Tac1有5个转录本变体,示意图表示了全长测序或3'末端测序。B、人类大脑皮层细胞类型聚类。C、2260个细胞在二维空间上的嵌入表示。D、小提琴图显示MGE来源的中间神经元中标志基因的表达。
三、单细胞表观基因组测序技术
基因表达部分地受到表观遗传调控,如DNA甲基化、组蛋白修饰等。这些修饰能够指导转录因子结合到特定的区域,从而促进或抑制基因的转录。一般mRNA的半衰期只有几分钟到几小时,而这些表观修饰能持续数月至数年。通过将表观基因组与转录组相整合,我们能洞悉细胞类型特异的基因表达调控机制。像snRNA-seq一样,单细胞表观基因组技术也可以通过提取细胞核来进行研究。这些方法能够让我们研究全基因组,其中95%以上的区域为非编码。非编码区域包含数百万的顺势调控元件,如启动子、增强子等。这些顺势调控元件一般表现为染色质开放、低水平DNA甲基化以及与启动子的三维构象互作。
3.1 DNA甲基化
在哺乳动物基因组中,胞嘧啶会被甲基化修饰。甲基化胞嘧啶通常发生在CG短序列上,与转录抑制密切相关。在脑细胞中,DNA甲基化具有两个不同于其他细胞类型的特征。首先,神经元有着高水平的羟甲基胞嘧啶,可能具有不同于甲基化胞嘧啶的功能。第二,在出生后发育过程中,神经元在非CG的位置上也发生甲基化,主要在CA和CT上。这些甲基化信号决定了神经元和胶质瘤细胞特异的基因表达调控机制。 单细胞DNA甲基化可以通过基于平板的细胞核分选方法进行测量,随后加入亚硫酸氢钠,进行多重测序,最终能捕获每个细胞中至多30%的基因组。亚硫酸氢钠将胞嘧啶转化为尿嘧啶(C>U),而具备甲基化的胞嘧啶则不受影响,从而通过测序能检测到胞嘧啶上的甲基化状态。利用这项技术,已对来自小鼠45个不同脑区超过11万的单细胞进行了研究,鉴定了约161种细胞类型。每种类型都有其特有的甲基化信号,与基因表达密切相关(图3A-3B)。
3.2 染色质可及性
像scRNA-seq/snRNA-seq, snATAC-seq可使用液滴方法或组合索引。组合索引的snATAC-seq能应用于冰冻脑组织,每次实验可获得超过1万个细胞。需注意的是,snATAC-seq仅能探测2%-3%左右的顺势调控元件。这种稀疏的覆盖能反映实验的敏感性,和细胞之间染色质可及性的异质性。尽管覆盖稀疏,但snATAC-seq仍能够可靠的区分神经细胞和胶质细胞。比如,在80万个小鼠的脑细胞中,每个细胞有着中位数为5000的唯一测序reads,共鉴定了160种细胞类型,包含约50万个可及性区域。由于染色质可及性区域,不像基因那样具有先验的知识,分析起来就较为复杂。目前,许多类型的特征,包括启动子、增强子等,均可用 snATAC-seq数据鉴定(图3E)。每种方法对不同的生物信号表现敏感,系统地比较分析对于实现最大的分辨率尤其重要。
3.3 染色质三维构像
顺势调控元件与基因启动子通过染色质loop和domain以三维构象的方式进行互作(图3C-3D)。单细胞染色质构象实验,类似于应用在组织样品中的HIC技术,可以对空间靠近的DNA区域进行解析,这些互作在一维水平上一般相距很远。一项应用在神经元中的单细胞HIC技术从每个细胞中平均获得了100万个互作,阐明了杆状光感受器细胞染色质倒置的发育,及嗅觉感受器基因在嗅觉感觉神经元中的分离过程。 染色质三维构象实验面临的一个挑战是巨量互作对的存在。即使单细胞HIC实验能够捕获到大部分互作,但最终获得的结果依然只有一小部分三维互作,这是因为一个DNA片段在实验中只能连接一次。单细胞HIC聚类分析能够鉴定具有相同染色质构象组成的细胞群体,但它对大脑皮质层的神经细胞类型并不能可靠地进行区分。一个替代策略就是使用约0.2um的组织切片,对单个细胞核应用激光捕获显微切割技术,从而获取同一部分的DNA片段。这确认了大多数神经元类型之间的染色质构象差异,但它无法提供单细胞分辨率水平的互作评估。
四、单细胞表观基因组在神经科学中的应用
4.1 构建基因调控网络
单细胞表观基因组能够用来构建转录因子和顺势调控元件网络。转录因子识别特定的短序列,长度一般为6-10个碱基。调控特定脑细胞类型的转录因子可以通过对一簇顺势调控元件做富集分析来鉴定。这个策略被应用到小鼠运动皮质层单细胞整合分析中,揭示了转录因子Rfx3在2/3层兴奋性神经元中的调控作用。
4.2 疾病风险关联(GWAS)
GWAS研究已揭示神经性疾病相关的风险位点,但是对于疾病相关的风险细胞类型,却仍然未知。利用单细胞转录组或表观基因组数据,我们可以获悉哪些细胞类型中所表达的基因(或顺势调控元件)是显著富集在GWAS位点附近,从而暗示细胞与疾病直接或间接的关系(图3F)。
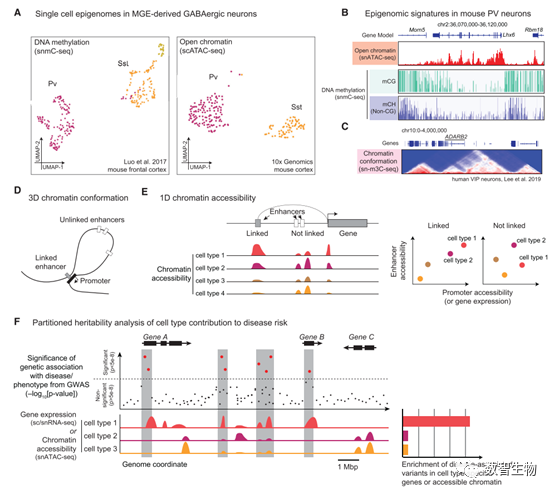
图3、 单细胞表观基因组。 A、MGE来源的抑制神经元的单细胞甲基化和染色质可及性图谱。B、基因组浏览器显示基因Lhx6的单细胞ATAC、甲基化图谱。C、额叶皮质VIP细胞的三维构象。D、染色质Loop结构表示,增强子与基因启动子互作。E、利用一维ATAC数据推断增强子和启动子互作。F、疾病相关细胞类型鉴定。
五、单细胞空间转录组测序技术
scRNA-seq/snRNA-seq通过破坏组织,达到细胞分离的目的,但是这丢失了细胞的空间位置信息。而就神经元而言,空间位置之间的连接信息对于细胞的身份和功能则至关重要。目前,这里有两种方法能够产生空间分辨率的单细胞转录组。一种是使用带有唯一标签的磁珠来基于脑组织切片的位置信息来标记mRNA分子,可获得10µm左右的空间转录组。然而想要更好的将转录本分配至每个细胞,则需要空间分辨率在1µm以下,这可以通过光学图像的方法来实现。单分子荧光原位杂交(smFISH)能够使用荧光寡核苷酸探针来灵敏的探测单个mRNA转录本。该技术由于需要探测很多mRNA转录本,需要预先设定一个探针集合,实验较为复杂,且十分耗时。 这些方法,在将来仍还有很多的提升空间。
六、单细胞多组学
全面系统地描述细胞身份需要联合测量基因表达与表观调控信息。虽然表观基因组数据能够被用来鉴定顺势调控元件,分析其与基因之间的关联,但是无法判定一个激活的顺势调控元件是否驱动了基因表达。因此,相同细胞中RNA表达水平测量是必要的。尽管单细胞转录组和表观基因组能通过计算方法进行整合,但显然更好的方法是直接进行单细胞多组学测序。
6.1 多模态测序
单细胞多组学测序同时对单个细胞的DNA和RNA进行测量。自2015年以来,这里已经报道了24种不同的多组学方法。这里,我们主要聚焦于应用到脑组织中的方法。 其中, scRNA-seq/snRNA-seq与snATAC-seq组合是十分重要的一个策略。这些方法通过转座酶标记开放染色质,随后逆转录mRNA达到组合实验的目的。通过这样的方法,研究人员已对胚胎和成年小鼠皮质层的15000个细胞进行研究,揭示了脑发育过程中细胞类型特异的基因调控网络。然而,这些实验在RNA覆盖度上仅是常规scRNA-seq/snRNA-seq的千分之一,平均每个细胞约拥有400-4000 RNA-seq reads 和 1000-6000 ATAC-seq reads,最终只鉴定了9-22个细胞类型,而scRNA-seq则鉴定了超过100种细胞类型。 多组学测序也能同时测量细胞的转录组和DNA甲基化。这些方法在RNA或DNA的覆盖度上与单独的scRNA-seq和单细胞DNA甲基化相当。DNA甲基化也能与ATAC进行组合,同时测量染色质可及性和DNA甲基化(NOME-seq)。 最后,DNA甲基化也可以与染色质三维构象实验进行组合。每条测序read包含两个维度的信息,DNA片段的空间连接信息和胞嘧啶甲基化状态。这项技术已被用来研究人类前额叶皮质层的4000个神经元,最终平均每个细胞能获得120万reads。染色质构象数据能够对主要神经细胞类型进行区分,如神经元细胞和星形胶质细胞,但无法对神经细胞亚型进行更加细致的区分。研究人员通过进一步结合DNA甲基化信息,对上述问题进行了克服。最终,该研究鉴定兴奋神经元特异转录因子SATB2与附近的一个非编码RNA存在显著互作。
6.2 单细胞测序与神经元生理学、形态学
单细胞测序能够与膜片钳技术结合(Patch-seq)来研究细胞转录组信号与生理、形态之间的联系。这种技术十分耗时,需要对每个细胞进行膜片钳记录,随后标记、成像、然后测序。尽管如此,研究人员已使用该技术对小鼠主要运动皮质层1300个细胞进行研究,基于转录组、形态、生理特性,鉴定了超过70种细胞类型。另一项研究则对3700个GABA能神经元进行研究,显示在特定的转录组分类中,抑制性中间神经元有明显的差异层流分布和电生理特性。同时,该项研究还指出将形态学、生理学特征与转录组信号进行一一对应十分困难。
6.3 单细胞测序与神经元连接性
通过利用病毒对轴突末端进行逆向感染,父本神经元的细胞体能被标记并可分选,随后转录组进行scRNA-seq/snRNA-seq,该技术称为Retro-seq。Retro-seq除了能对细胞体中的转录组进行分析以外,也保留了轴突上的信息。通过利用这种方法,研究人员在小鼠的运动皮层发现位于第5层锥体束神经元的亚群在丘脑中有明显的突起以及髓质在运动控制中的不同作用。
七、单细胞测序数据分析
单细胞测序数据集有着成千上万的特征,且测量了数千到上百万的细胞。分析这些数据要求复杂的计算程序,不同的分析流程对结果有着十分显著的影响。开源的软件包允许神经生物学家能够使用这些复杂的策略。这里,我们对众多工作流中较为普遍的环节进行讨论。
7.1 质控、比对、定量
单细胞数据集分析的第一步一般是将reads分配到指定的细胞类型,而后比对参考基因组或转录组。该阶段,需要有效的去除低质量的细胞。虽然不同的单细胞测序技术缺陷不一,但一般普遍的问题是由于RNA/DNA捕获无效导致较低的文库复杂性,高丰度的线粒体RNA污染和DNA甲基化测序中不充分的重亚硫酸盐转化。在大多数情况下,通过选取合适的阈值,低质量细胞是能够有效去除的。在质控和定量完成后,我们可以得到基因表达矩阵。
7.2 特征选择与降维
基因表达和表观基因组测量包含高维的特征,通过降维能够减少数据噪音并简化后续的分析。首先,低表达或低方差的基因应该被移除。然后,利用主成分分析将数千个特征线性降维至约50-100个特征。对于选择多少主成分进行后续分析,这里没有明确的约束,在实践中,结果对该值的选择并不是特别敏感,受影响不大。
7.3 降低数据稀疏性
单细胞数据通常稀疏。在scRNA-seq/snRNA-seq中,一些基因可能在细胞中出现缺失,而snATAC-seq则只能捕获所有染色质可及性中一小部分。对数据进行预处理,有助于减少稀疏性,并可以改善可视化和聚类分析。
7.4 双细胞
单细胞实验一个普遍的问题就是不正确地合并了来自两个或两个以上的细胞,称之为多细胞。这种情况,可以发生在液滴或微孔捕获的时候。组合索引方法也可能由于混合不够充分,从而偶然造成多个细胞获得相同标签的情况。一些双细胞能够通过分析异常高的表达信号而得以移除。
7.5 可视化
单细胞数据可视化可以让我们更加直观的理解数据的意义,且有助于我们后续的统计分析。可视化通过将细胞嵌入二维或三维空间,且尽量保留它们在高维空间的距离。非线性流形学习和数据嵌入技术,包括tSNE、UMAP等,这些方法在数据处理上采用了不同的妥协策略,以使单细胞特征向量间的复杂关系能在二维或三维进行合理表示。更复杂的方法,如变分自编码器,也已被应用到单细胞数据中。低维嵌入总是不那么完美,它们是歪曲的,并不是高维数据的唯一表示。这些方法应主要用于数据探索,而不宜直接从中得出结论。
7.6 离散簇和连续的隐藏因子
单细胞数据集的最简单描述就是看这里有多少个独立的簇被鉴定。然而,聚类分析并不能对最终获得的细胞类型的可靠性做出保证。此外,在一个独立的簇中,细胞也可能会表现出明显差异,呈现出连续的状态变化。这种连续的轨迹通常在脑发育,细胞分化过程中存在。应用拟时分析算法,可以对细胞间分化轨迹进行重构。
7.7 多数据集整合
相关的转录组和表观基因组信号能够通过计算方法进行整合。一些参数方法,像seurat中近似相关性分析(CCA)或非负矩阵分解(NMF),能够将细胞投射到一个共同的低维空间,使得它们能够被直接比较分析。另外一些非参数方法,像MNN,能将多个数据集中的细胞直接进行关联,而不需要将其投身到一个共有的低维空间。
7.8 簇验证
簇的可重现性可帮助确定簇是否可靠。一个严谨的方案是在一个或多个数据集中进行学习,然后再在另一个独立数据集上进行验证,并使用AUROC统计得分来评估簇之间的匹配情况。用这个方法,主要的GABA能神经元类型信号在独立的scRNA-seq数据集中得到了验证。另外,表观基因组信号能更进一步验证细胞类型,并帮助解析其分子调控网络。
7.9 下游分析
在聚类和簇验证后,许多分析能够更进一步来探索单细胞数据。像对不同细胞类型,不同样本,不同条件进行差异分析。不幸的是,不同的计算方法对差异基因评估的结果存在较大差异,且那些专门被设计用来分析scRNA-seq/snRNA-seq数据的方法可能还没有bulk RNA-seq的分析方法好。另外,单细胞表观基因组数据可以用来鉴定顺势调控元件,分析差异甲基化区域,锁定顺势调控元件与基因之间的调控关系。这些数据可以用来阐明基因调控网络,帮助预测潜在的细胞类型特异的增强子。
八、限制、机会与展望
单细胞测序技术正在转变许多生物学领域,它在神经生物学领域的影响尤其深刻。脑细胞类型的复杂性,以及细胞身份的复杂调控模式,使得单细胞分析对于我们理解脑功能十分关键。与其他任何刚兴起的技术一样,单细胞测序存在着重要的局限。双细胞,即多个细胞拥有相同的标签,能够扭曲单细胞数据集,造成一些奇怪的杂合细胞类型。scRNA-seq污染能够导致假阳性基因探测,如来自其他细胞中的RNA。而假阴性,可能是一个更明显的问题,因为取样策略只恢复了总RNA或DNA的一小部分。此外,在组织切割和细胞解离期间,可能会导致非生理性地转录激活,从而引入技术噪音。 单细胞技术,一个最基本地局限就是需要破坏细胞,提取分子信息进行测序。尽管多组学方法能够从每个细胞中获取更多地信息,但是这些只是细胞生命活动某个瞬间的记录。而对于神经元活力,动态的表达变化,对于我们理解脑功能尤为关键。尽管一些动态变化信息能够通过比较分析成熟和不成熟的mRNA分子做出推断,但是真正的动态转录组测量在脑功能研究中更有价值。 单细胞数据的复杂性既是一项机会,也是一项挑战。复杂地计算方法,如聚类、可视化以及其他分析为细胞功能提供了丰富的视野。然而,不同的计算方法或参数选择会使得同一个数据集得到不同的结果。聚类方法很难保持数据间的一致性,缺乏明显的鲁棒性,导致主观的去描述细胞类型。单细胞研究需要明确阐明所选择的参数,和公开使用的分析代码,为了保证结果的可重现性。 单细胞数据最大的挑战在于将测序信息与功能以及生理信息进行整合。虽然转录组、表观基因组、解剖和形态学尺度能在细胞水平上一一对应,但如何在数百种不同的细胞类型中来协调这些信息仍然处于早期阶段。 随着单细胞技术不断的克服这些挑战,它们将打开神经科学研究中的新领域。单细胞测序将提供更综合的,多物种的,不同发育阶段的全脑分析。像将单细胞测序与电生理学、形态学、连接性有机结合,正深刻的改变我们对神经元多样性地理解。物种间脑细胞类型比较分析将为我们提供一个关于神经元细胞更细致的进化关系。进化保守型和差异已揭示负责认知功能的基因调控程序。随着技术的不断进步,海量的单细胞数据将转化为系统的、有组织的知识。
九、参考文献
Ethan J. Armand, Junhao Li, Fangming Xie, et al. Single-Cell Sequencing of Brain Cell Transcriptomes and Epigenomes. Neuron. 2021 Jan 6;109(1):11-26.